Настольный высокопроизводительный NGS-секвенатор для различных применений. Имеет возможность проведения генерации кластеров ДНК и секвенирования в одном приборе, без выполнения ручных операций. Для удобства управления системой имеется встроенный сенсорный экран. Секвенатор также имеет полный набор программного обеспечения (с возможностью обновления) для управления системой и первичной обработки данных и встроенный аппаратный модуль для ускорения вычислений
Основные применения высокопроизводительного NGS-секвенатора GenoLab M
- секвенирование экзома;
- секвенирование полных геномов;
- таргетное секвенирование (ампликоны, панели генов);
- секвенирование транскриптомов;
- метагеномное секвенирование;
- анализ степени метилирования ДНК;
- анализ ДНК-белковых взаимодействий;
- секвенирование свободно-циркулирующей ДНК;
- НИПТ, ПГТ-А.
Характеристики NGS-секвенатора GenoLab M
- количество рабочих ячеек секвенатора, шт. – 2;
- возможность запуска двух ячеек независимо (запуск второй ячейки во время текущего запуска первой ячейки);
- возможность управления прибором с помощью сенсорного экрана;
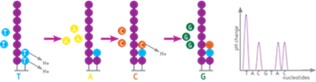
- количество типов нуклеотидов, одновременно подаваемых в реакционный модуль в каждом цикле секвенирования – 4;
- максимальное количество прочтений на одну ячейку, млн – 500;
- максимальная производительность за один полный запуск прибора, Гб – 300;
- поддержка одноконцевых и парноконцевых прочтений;
- максимальная длина считываемого фрагмента ДНК при чтении с одного конца, нуклеотидов – 150;
- максимальная длина считываемого фрагмента ДНК при парноконцевом чтении, нуклеотидов – 300;
- максимальное время, необходимое для полного цикла работы прибора (включая генерацию кластеров, секвенирование ДНК и первичный анализ данных), ч – 72;
- поддержка библиотек TruSeq и Nextera;
- средняя точность прочтения по результатам всего запуска (Q30) – 80% оснований с точностью прочтения 99,9%;
- требования к сети – 220 В; 50/60 Гц;
- габаритные размеры (Ш×Г×В), мм – 1200×685×595;
- вес, кг – 280.
Комплектация секвенатора GenoLab M
- секвенатор;
- стартовый набор для инсталляции и обучения;
- набор для секвенирования (на выбор в зависимости от задач пользователя);
- источник бесперебойного питания;
- управляющий ПК (операционная система — Windows 10 Pro, CPU: Xeon SR 4216, Память: 192 DDR4; Hard Disk 1: 1 TB SSD; Hard Disk 2: 10 TB HDD);
- монтаж, пуско-наладка, инструктаж персонала на рабочем месте;
- гарантийное обслуживание 12 месяцев (возможна покупка дополнительной гарантии).