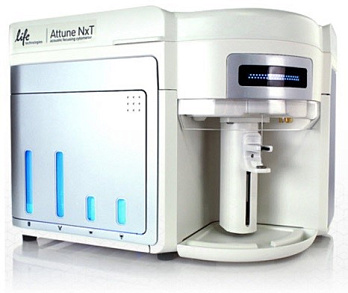
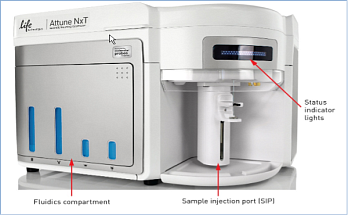
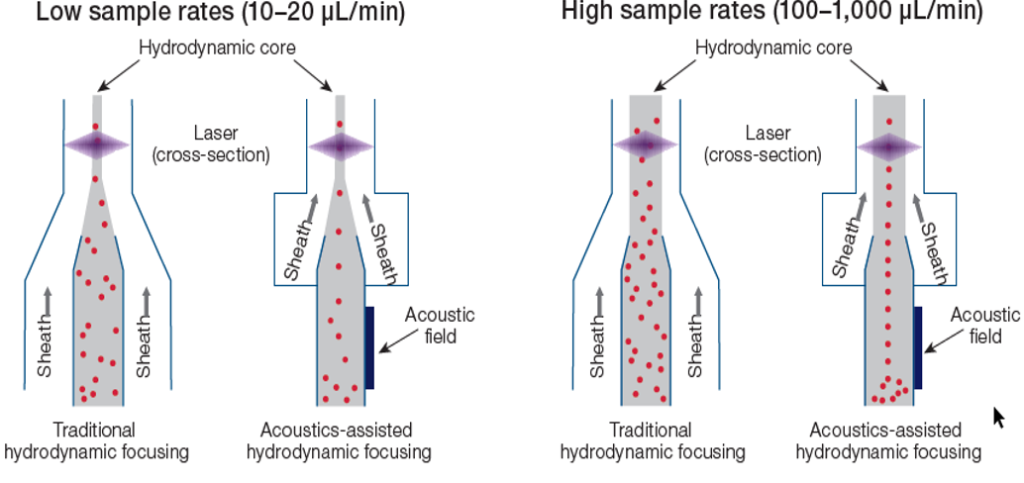
Уникальная особенность Attune NxT — функция акустической фокусировки, позволяющей проводить измерения с высокой скоростью без потери качества, сохраняя низкую вариабельность.
Возможности Attune NXT при анализе плоидности
- Высокая скорость измерения с сохранением низких значений коэффициента вариации;
- возможность использовать готовые реагенты Thermo FS для окраски ядер или использовать реагенты сторонних производителей;
- отработанные протоколы для разных задач в анализе плоидности;
- классический анализ плоидности при помощи голубого лазера (488 нм) и йодистого пропидия;
- возможность установки дополнительных лазеров (можно докупать после покупки прибора);
- легкая замена фильтров при необходимости их оптимизации;
- возможность использовать опциональный автосэмплер и роботизированную подачу для автоматической смены образцов и ускорения производительности;
- универсальность — при необходимости прибор можно использовать и для других задач в области проточной цитометрии.
Технические характеристики Attune NXT
- Лазеры — 1 (488 нм, 50 мВт), возможен апгрейд на рабочем месте пользователя до 4х-лазерной конфигурации;
- профиль лазера: 10×50 мкм, с плоской вершиной;
- каналы детекции — FSC¹, SSC², 4 флуоресцентных (до 14 флуоресцентных параметров при покупке дополнительных лазеров);
- чувствительность MESF³ — ≤ 80 MESF for FITC, ≤ 30 MESF for PE;
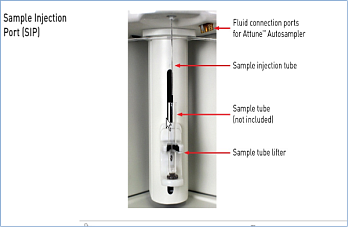
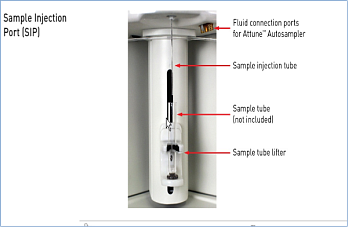
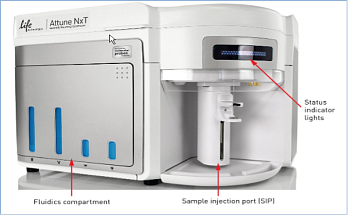
- формат загрузки — пробирки размерами от 17 x 100 мм до 8,5 x 45 мм (включая стандартные пробирки на 1,5, 2 и 5 мл), опциональный автозагрузчик для 96- и 384-луночных планшетов;
- скорость потока — 12,5-1000 мкл/мин;
- скорость сбора данных — до 65 000 событий/сек;
- метод определения концентрации частиц — прямой подсчет;
- габариты, Ш × Г × В — 400 × 580 × 430 мм;
- вес — 29 кг.
¹ forward scatter, прямое светорассеивание;
² side scatter, боковое светорассеивание;
³ molecules of equivalent soluble fluorochrome, число молекул эквивалентного растворимого флуорохрома.
Примеры статей с использованием проточного цитофлуориметра Attune NxT
1) An Advanced Protocol for the Quantification of Marine Sediment Viruses via Flow Cytometry Mara Elena Heinrichs, Daniele De Corte, Bert Engelen and Donald Pan.
Разработка протоколов для подсчета вирусных частиц с помощью проточной цитометрии Attune NxT в морских донных отложениях.
doi.org/10.3390/v13010102.
2) Control of Multigene Expression Stoichiometry in Mammalian Cells Using Synthetic PromotersYash D. Patel,Adam J. Brown, Jie Zhu, Guglielmo Rosignoli, Suzanne J. Gibson, Diane Hatton, David C. James.
Использование Attune NxT для контроля стехиометрии мультигенной экспрессии, с использованием синтетических промоторов в клетках млекопитающих.
doi: 10.1021/acssynbio.0c00643.
3) Immunomodulatory Responses of Two Synthetic Peptides against Salmonella Typhimurium Infection. Marco Antonio Ibarra-Valencia, Gerardo Pável Espino-Solis, Blanca Elisa Estrada and Gerardo Corzo.
Иммуномодулирующий потенциал синтетических антимикробных пептидов оценивали путем определения профилей экспрессии цитокинов с помощью проточного цитометра Attune NxT.
doi: 10.3390/molecules26185573.
4) ATP13A3 is a major component of the enigmatic mammalian polyamine transport system. Norin Nabil Hamouda, Chris Van den Haute, Roeland Vanhoutte, Ragna Sannerud, Mujahid Azfar, Rupert Mayer, Álvaro Cortés Calabuig, Johannes V Swinnen, Patrizia Agostinis, Veerle Baekelandt, Wim Annaert, Francis Impens, Steven H L Verhelst, Jan Eggermont, Shaun Martin, Peter Vangheluwe.
Attune NxT использовался для изучения новых компонентов системы транспорта полиаминов через мембрану у млекопитающих.
doi: 10.1074/jbc.RA120.013908.
5) Microengineered perfusable 3D-bioprinted glioblastoma model for in vivo mimicry of tumor microenvironment. Lena Neufeld¹, Eilam Yeini¹, Noa Reisman¹, Yael Shtilerman¹, Dikla Ben-Shushan¹, Sabina Pozzi¹, Asaf Madi², Galia Tiram¹, Anat Eldar-Boock¹, Shiran Ferber¹, Rachel Grossman³, Zvi Ram³, Ronit Satchi-Fainaro¹ ⁴ *.
В лабораторных исследованиях многие лекарственный препараты показывают многообещающие результаты, но в конечном итоге не проходят клинические испытания. Современные модели рака неадекватны и это основная проблема. У большинства моделей отсутствует взаимодействие опухоль – строма, для правильного представления комплексной биологии рака. Гетерогенное микроокружение фибриновой глиобластомы, состоящей из клеток глиобластомы, астроцитов и микроглии, воспроизвели материалом полученным от пациентов. 3D-модель может стать основой для быстрого, воспроизводимого и надежного обнаружения цели, персонализированный скрининг, разработка лекарств, и потенциально заменить клеточные культуры и модели животных, в качестве мощной платформы.
Проточний цитофлуоримета Attune NxT использовался для оценки экспрессии Р-селектина в клетках, выращенных в 2D-культуре (2D culture) и в фибрине – 3D-бионик (fibrin 3D-bioink). С помощью проточного цитофлуориметра Attune NxT показан высокие уровни экспрессии P-селектина на клетках PD-GB4, выращенных в фибрине – 3D-бионик по сравнению с 2D культурой. doi: 10.1126/sciadv.abi9119.