
История
Часть товаров из корзины будет перемещена в статус отложенных и не сможет быть оформлена для заказа, если вы продолжите работу в данном регионе
История

История
История

Идея цифровой ПЦР появилась буквально через пару лет после того, как был открыт сам метод ПЦР. В 1985-6 г опубликована первая статья, описывающая принцип цПЦР. Суть его заключалась в том, что реакционную смесь из пробирки с образцом следует раститровать на такое количество пробирок, чтобы в каждой было по одной нуклеиновой кислоте. Потом содержимое пробирок амплифицируется, после чего анализируется результат.
Эта концепция цифровой ПЦР впоследствии эволюционировала. В 2005-6 гг. компания Fluidigm (и она была не единственной) вышла на рынок с первым прибором для цифровой ПЦР. «В массы» эти новинки не пошли примерно до 2009-10 г., когда уже BIO-RAD вышла на рынок со своим прибором.
Итак, цПЦР – это аналитическая техника определения концентрации нуклеиновых кислот, основанная на ПЦР-амплификации единичных молекул образца без использования стандартов, если это количественная оценка.

Имеющийся образец определенным образом разносится на определенное количество лунок – их можно назвать микрореакторами. У разных производителей реализация разная, но важно, чтобы в каждом микрореакторе оказалось по одной молекуле. Далее происходит амплификация и в конечном итоге чтение результатов и анализ на выходе. По сути это детекция флуоресценции по конечной точке, где можно увидеть положительные и отрицательные точки.
Вся цифровая ПЦР описывается статистикой и моделью Пуассона. В среднем в каждой лунке находится по одной нуклеиновой кислоте. В каком-то случае в одну ячейку попадет и по две, и по три молекулы. Главное – чтобы были «отрицательные» лунки, которые позволяют сформировать модель. И при этом следует понимать, что большинство из них будет содержать все-таки по одной молекуле.
Таким образом при амплификации достигаются наиболее высокие чувствительность, специфичность и точность цПЦР.
Фотография отображает чип с положительными и отрицательными результатами: есть амплифицированные и неамплифицированные ячейки. На основании полученных данных программа рассчитывает количество нуклеиновой кислоты, которое было в реакции.
Количество копий на реакцию фиксировано: Thermo Fisher рекомендует от 1 до 39. Все методики расчета и применения метода описаны в мануале за одним большим исключением: вся цифровая ПЦР на сегодня в первую очередь адаптирована только под геномные задачи и в первую очередь под человеческий геном. Это особенно связано с онкологией.
Поэтому, если проводить цифровую ПЦР предстоит на каком-то другом образце (в качестве исходного материала выступает не человеческий геном), пользователю придется несколько адаптировать свою систему и произвести перерасчеты. Например, если речь об исследовании каких-то инфекций на фоне человеческой ДНК. Если материал чистый – с ним работать проще. Так или иначе, систему придется адаптировать под организм, с которым планирует работать пользователь.
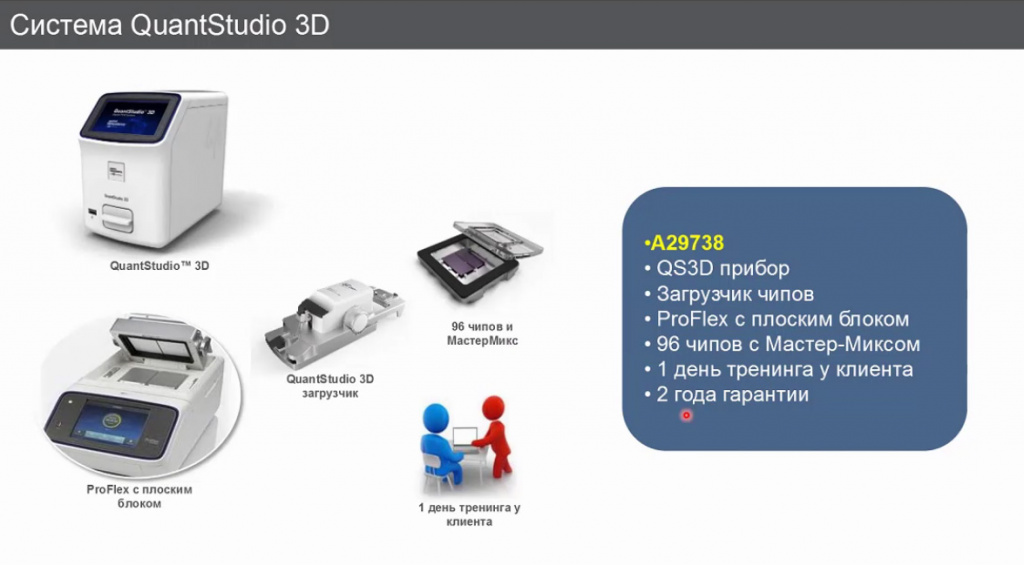 Система называется QuantStudio 3D(от «диджитал»).
Система называется QuantStudio 3D(от «диджитал»).
Пользователь, который ее приобретает, сразу получает:
В отличие от прибора производства BIO-RAD, «термофишеровский» прибор калибровки не требует.
У прибора три канала: FAM, VIC и ROX, но третий «роксовый» канал –нерабочий, технический. МастерМикс содержит референсный краситель ROX, по нему прибор оценивает заполняемость чипа (насколько хорошо заполнение произошло).

В первую очередь – определение концентрации. В данном случае цифровая ПЦР не зависит от значения контроля, а напрямую показывает результат.
Во-вторых, цПЦР позволяет детектировать единичные молекулы матрицы даже при низкой концентрации.
Собственно, идея цифровой ПЦР в этом и заключается, чтобы выловить именно эти единичные молекулы, которые на фоне «дикого» типа не будут амплифицироваться.
Если взять пробирку с мутантной молекулой и «общую», проанализировать в «реалтайм» и цПЦР, разница будет существенна: в «реал-тайм» есть риск не увидеть сигнал от искомой молекулы. А в цифровой ПЦР результаты будут одинаковы, так как для амплификации каждой молекулы будут использоваться одинаковые условия.
Цифровая ПЦР не нуждается в количественных стандартах для получения количественных результатов. Она сама по себе разу же автоматически их выдает. Более того, цифровая ПЦР является инструментом, который позволяет производить эти количественные стандарты для «реал-тайма». При этом не требуется никакой стандартной кривой, на экране прибора видятся количественные значения сразу же.
 «Реал-тайм» (кПЦР) очень сильно зависит от эффективности набора: насколько хорошо подобраны праймеры, подобраны зонды, присутствуют ли ингибиторы в самой пробе. Результаты анализа зависят от корректировок базовой линии, от калибровки инструмента, если это необходимо. Для количественного определения в данном случае нужен стандарт.
«Реал-тайм» (кПЦР) очень сильно зависит от эффективности набора: насколько хорошо подобраны праймеры, подобраны зонды, присутствуют ли ингибиторы в самой пробе. Результаты анализа зависят от корректировок базовой линии, от калибровки инструмента, если это необходимо. Для количественного определения в данном случае нужен стандарт.
В цПЦР не нужно стандартов, эффективность ПЦР влияет на результат в меньшей степени – в первую очередь с точки зрения присутствия ингибиторов. При использовании этого метода происходит подсчет точного числа молекул, присутствующих в образце.
Важно понимать, что подменять эти понятия, как делают многие наши конкуренты, нельзя: цПЦР никогда не заменит «реал-тайм». Но расширяет возможности последнего. То, что нельзя делать «реал-таймом», можно достичь цифровой ПЦР. Но если что-то может цПЦР, и «реал-тайм», то «реал-тайм» будет дешевле примерно на порядок.
Если есть сложные матрицы и сложные образцы с минимальным количеством образца, то нужно задействовать цифровую ПЦР. Практика показывает что необходимость цПЦР составляет 1-25, максимум 30 образцов из всего пула образцов, с которыми приходится работать, а в среднем это 10-15 образцов, которые придется анализировать с использованием цПЦР, поскольку они не укладываются в общую картину с «реал-тайм». Это касается в первую очередь экспрессии, может быть, экспрессии единичных клеток, там можно использовать цПЦР.
Таких лабораторий мало. В первую очередь это некая рутина, копийность, это экспрессия. Но опять же этих вещей, которых нельзя достичь «реал-таймом», очень мало, однако они все же существуют.

Процедура включает 4 шага:
Важный момент: получается запечатанная система. Чип запечатывается напрочь и уже не открывается в процессе чтения. Это не свойственно, например, для «биорадовской» системы, у которой по окончании процесса проточный цитометр прокалывает стрипы или плашку, запечатанную пленкой, забирает оттуда образец, анализирует его. Это приводит к риску контаминации помещения, где проводится анализ. Известны случаи такой контаминации лабораторий биорадовской машиной. В связи с этим проточный цитометр рекомендуют ставить отдельно – например, в зоне, где производится электрофорез, чтобы свести к минимуму последствия контаминации.
С оборудованием Thermo Fisher этого не происходит: образец остается запечатанным и потом выбрасывается, поскольку он после анализа уже в принципе не нужен.
 В первую очередь и единственное, для чего используется цПЦР – обнаружение редких событий, редких настолько, что их нельзя определить посредством «реал-тайм».
В первую очередь и единственное, для чего используется цПЦР – обнаружение редких событий, редких настолько, что их нельзя определить посредством «реал-тайм».
Но! Если вы обнаруживаете какую-то мутацию, которая не обнаружена, то можно использовать капиллярный электрофорез, а в случае, если и его чувствительности не хватает, стоит переходить к цифровой ПЦР. Но опять-таки на сегодня наша система NGS и наши решения для NGS позволяют детектировать 0,1 процента мутаций.
Так что чувствительность NGS на сегодня подошла к чувствительности цПЦР. Но возвращаясь к первому слайду, отметим: в случае одного образца и одной мутации запускать NGS нецелесообразно. Можно запустить цПЦР. Или реалтайм. Правда, его чувствительности может не хватит. Поэтому придется запускать NGS.
Вообще чувствительность такова, что можно «вылавливать» и еще меньшие количества. Вопрос: является ли это действительно решением или это некий артефакт? Прибор видит просто точку, но нужна некая статистика, чтобы понять, реально это мутация или нет?
 Определение копийности генов
Определение копийности геновКопийность генов тоже можно делать методом цПЦР. Если у вас двукратное различие в копийности, то «реалтайм» спокойно с этим справится. Если не кратное различие, нужно прибегать к цПЦР: он чувствительнее.
У нас в стране никто не использует цПЦР для определения химеризма, но в мире используют. Слайд и таблица показывают, что результаты обследования после пересадки «реалтайм» и цПЦР показывают по-разному: по цПЦР мы видим результат уже на 62 день, по «реалтайму» только на 192 день.
Определение редких патогенов бывает необходимо, но важно соотносить цель и пути ее достижения. Так, просто для определения абсолютной вирусной нагрузки нет смысла стремиться к особой точности, потому что значение нагрузки нужно только для схемы лечения. А схема лечения укладывается в определенные масштабы и границы, поэтому точное определение значений вирусной нагрузки не имеет смысла.
Другое дело, когда мы говорим о каких-то важных инфекциях, например, гепатит С (очень показательный пример) в период сероконверсии – пока еще нет антительного ответа, не определяется ДНК – а это первые три месяца после инфекции. Вот тогда цПЦР приобретает особую важность для станций переливания крови, которые «вылавливают» опасную инфекцию, но могут пропускать. Именно цПЦР может в данном случае помочь – не абсолютно, но как вариант.
Можно увидеть сравнение результатов исследования методами кПЦР и цПЦР в таблице данных внутреннего контроля по гепатитам B, C и ЦМВ. Видна разница доверительных интервалов «реал-тайма» и цПЦР.
Вот еще слайд, показывающий преимущество цПЦР перед «реал-таймом». Условия: залив Сан-Франциско, сточные воды, для которых производится обнаружение патогенов и амплификация.
Серый график – реалтайм, синий – цПЦР. Видно влияние концентрации гуминовых кислот на ингибирование «реалтайм». Снижение обнаружения идет и у цПЦР, но не такое драматичное, как у «реал-тайм», потому что гуминовые кислоты напрочь «убивают» амплификацию. Но в случае цПЦР такого не происходит, опять же потому, что в какую-то лунку попали ингибиторы, в какую-то они не попали, и там будет проходить амплификация.
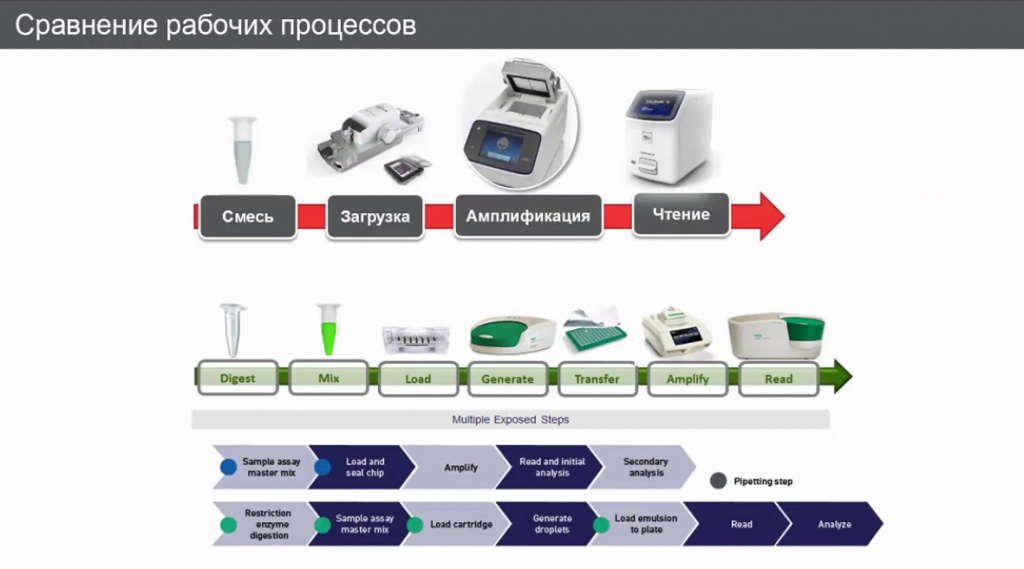 Было проведено сравнение рабочих процессов между приборами от Thermo Fisher и BIO-RAD: отличия между двумя системами налицо.
Было проведено сравнение рабочих процессов между приборами от Thermo Fisher и BIO-RAD: отличия между двумя системами налицо.
Вот этот самый проточный цитометр по сути, который может сильно контаминировать , прокалывая плашку и забирая оттуда образец на анализ.
У нас такого не происходит, но с другой стороны у них эта система масштабируемая и масштабируется на 8, не меньше. Это к вопросу о цене – если, например, в лаборатории используется BIO-RAD и количество образцов не равно восьми, цена вопроса будет вырастать. Потому что для создания образца и генерирования капель используется специальное устройство – гаскет, он идет минимум на 8 образцов. И заполнение маслом, из которого генерируются капли, будет идти на 8. Меньше у вас образцов или 8, расход все равно идет на 8. От этого будет и сильно варьировать цена.
У Thermo Fisher это нормируется на один. Вопрос, насколько важны эти различия, зависит от того, что лаборатория делает, какую работу она проводит.
Если некоторые сотрудники BIO-RAD, например, рекомендуют перейти на цПЦР, потому что это более чувствительный метод, и он дает более надежные результаты, это правда – так и будет, но за это вы будете платить. И это будет медленнее, чем сделать «реал-таймом». А практика показывает, что люди, которые начинают активно хотеть цПЦР, в конечном итоге «успокаиваются» и переходят обратно на «реалтайм». Выглядит это красиво: пользователи думают, что им это необходимо, но по факту оказывается, что все вопросы лаборатории решаются посредством банального «реал-тайма». Поэтому важно отдавать себе отчет в том, что лаборатория планирует делать и с каким количеством образцов она планирует работать. Это существенно, например, потому, что наша система в два или хотя бы в полтора раза дешевле, чем «биорадовская». Если у нас «это стоит» примерно 5 млн руб. даже 5,5 млн., а цены на «биорадовские» машины начинаются от 8 млн. руб. и достигают 12 млн, если имеют автоматическую станцию раскапывания. Стоит подсчитать!
Получается, что у нас номинально за единицу – за образец – подороже, у «BIO-RAD» дешевле, но у них дороже аппаратура, и в конечном счете можно долго дискутировать, что целесообразнее.
С помощью личного кабинета Вы сможете:
Сравнение